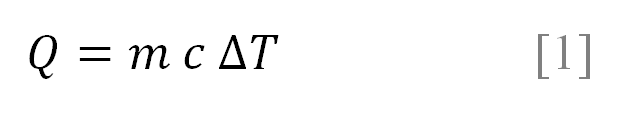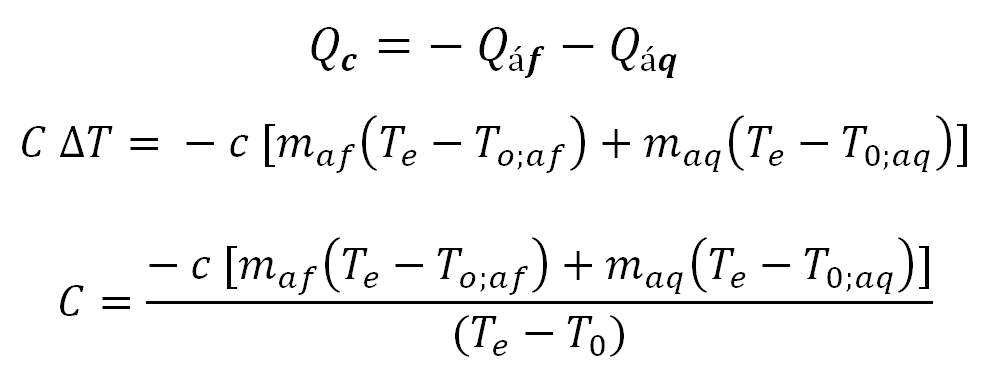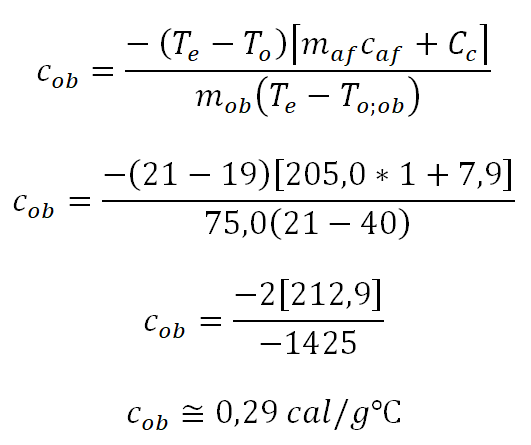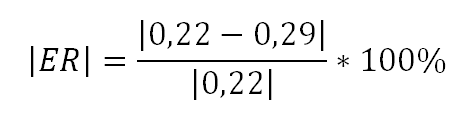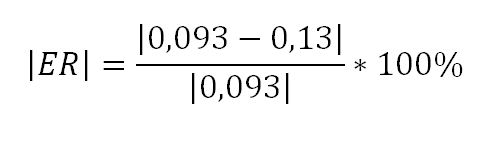Experimento de Física: Calor Específico

|| No experimento realizado em equipe de três alunos, determinamos o calor específico de duas substâncias, já estabelecidas pelo roteiro, que são o alumínio e o cobre. O método utilizado, com os instrumentos de experimentação disponível, foi à divisão de tarefas de cada integrante do grupo, na atenção cuidadosa dos dados no momento de coleta de temperaturas e massas. Por fim, verificamos por meios de cálculos resolutivos, inicialmente com o a resolução da capacidade térmica do calorímetro, os calores específicos do alumínio e do cobre.
Introdução
A definição de caloria indica quantidade de energia necessária para elevar a temperatura de 1 g de uma substância específica, a água, a 1 grau, que é 1 cal (caloria). Para elevar a temperatura de 1 kg de água, precisamos transferir 1 kcal de energia. A quantidade de energia necessária para elevar em 1 grau a temperatura de 1 kg de uma substância qualquer varia de acordo com a substância. Por exemplo, a energia necessária para elevar a temperatura de 1 kg de cobre 1,0 ºC é de 92,45 cal, aproximadamente, e de energia em Joules é de 387 J, significamente menor do que aquela necessária para água. Cada substância requer uma quantidade única de energia por unidade de massa para mudar 1,0 ºC a temperatura dessa substância. (SERWAY e JEWETT, 2013, p. 591, adaptação nossa).
Para elevar a temperatura inicial para uma temperatura final de uma amostra de massa m é necessário transferir uma quantidade de energia, que está diretamente relacionada com seu calor especifico c.
De modo que a razão de Q é:
Logo:

Sendo que o calor específico em unidade é de cal/g ºC.
E a capacidade térmica C, que o próprio nome já diz, a capacidade energética necessária para variar a temperatura de um corpo, é a razão da quantidade de energia por variação de temperatura, de modo que se expressarmos algebricamente, teremos o resultado, que a massa é diretamente proporcional pelo produto do calor específico, ou seja, quanto maior for a massa desse corpo, maior será a sua capacidade térmica.
Expressada pela seguinte equação:

Sendo que Capacidade Térmica em unidade é cal/ºC.
Procedimento Experimental
Em resumo, para se encontrar os calores sensíveis das substâncias, primeiro identificamos experimentalmente a capacidade térmica do Calorímetro.
Onde:
Como se pode ver na equação, ao atingir o equilíbrio térmico das três massas juntas, sua igualdade se anula, por não haver mais a transição de calor.
Sendo que:
- Te: é a temperatura de equilíbrio térmico
- T0: é a temperatura inicial
Determinado a capacidade térmica do calorímetro, substituímos na equação, da soma das quantidades de energias do objeto/substância - alumínio/cobre, da água e do calorímetro, para se calcular o calor específico dos objetos.
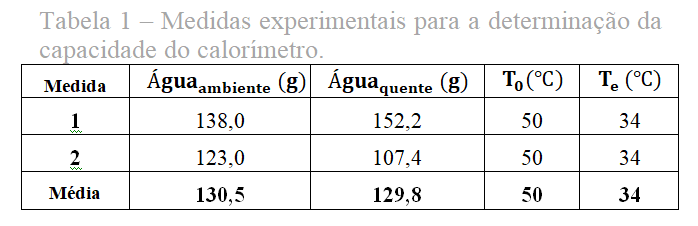
No ato experimental, coletamos uma quantidade considerável de água líquida, acima de 100 ml, em um béquer, e medimos a sua massa na balança analítica, que registrou a sua estranha massa de 13,80 g, sabemos que a propriedade da água em volume possui o mesmo em gramas. Então concluímos que o registro mostrado na balança é na verdade 138 g.
Figura 1. Balança analítica. (Fonte: autoria própria - Laboratório de Química | Uniandrade).
Pegamos essa amostra de água e colocamos no calorímetro, até que atingisse o equilíbrio térmico entre eles, já contendo um termômetro em escala Celsius para medir sua temperatura.
Figura 2. Calorímetro com a amostra de água, juntamente com o termômetro, para medir seu equilíbrio térmico. (Fonte: autoria própria - Laboratório de Química | Uniandrade).
Em quanto isso, coletamos outra amostra de água líquida, acima de 100 ml, em um béquer graduado, e esquentamos em um bico-de-bunsen.
Figura 3. Béquer com a amostra de água sendo aquecida pelo bico-de-bunsen, e um termômetro na vertical, para medir sua temperatura final de 50 ºC. (Fonte: autoria própria - Laboratório de Química | Uniandrade).
Depois de aquecida a água em 50 ºC medimos a sua massa, registrada na balança analítica 152,20g.
Voltamos ao calorímetro e verificamos a sua temperatura final, que registrou 19 ºC. E colocamos a água aquecida no calorímetro, após dois minutos, atingiu seu equilíbrio térmico em 34 ºC.
Concluímos a primeira medição.
Tabela 1, dados coletados de somente de duas medições experimentais, autorizadas pelo professor regente. E o cálculo resolutivo de sua média aritmética simples.
Para a segunda parte do experimento, medimos as massas do alumínio e do cobre.
Na determinação dos dados do objeto alumínio, no intuito de aquecê-lo, coletamos água líquida em béquer, e esquentamos, em "banho-maria", no bico-de-bunsen, até atingir 40 ºC, que nesse caso é a temperatura inicial.

Figura 4. Béquer com a amostra de água sendo aquecida pelo bico-de-bunsen, junto com o objeto alumínio, e um termômetro na vertical, para medir sua temperatura final de 40 ºC. (Fonte: autoria própria - Laboratório de Química | Uniandrade).
Com a outra amostra de água líquida (com a sua massa determinada) já no calorímetro e na sua temperatura equilibrada de 19 ºC retiramos o alumínio do béquer, e a colocamos no calorímetro, depois de dois minutos medimos a sua temperatura do equilíbrio térmico. E assim sucessivamente medimos e coletamos os dados da outra massa, com o mesmo procedimento experimental.

Na Tabela 2, dados coletados experimentalmente, para a medição dos calores sensíveis do alumínio e do cobre, com seus respectivos cálculos da média aritmética simples.
Resultados e Discussões
Na primeira parte do experimento dos dados coletados, determinou-se a capacidade térmica do calorímetro.

Resultados e Discussões
Na primeira parte do experimento dos dados coletados, determinou-se a capacidade térmica do calorímetro.
Calor sensível do Alumínio:
Calor sensível do Cobre:
Em primeiro instante os calores sensíveis das substâncias está próximo do esperado, pra analisarmos mais precisamente essa diferença podemos calcular através do módulo do erro relativo e multiplicarmos em 100%, expressada pela seguinte equação:
Onde:
- ER: Erro Relativo
- VV: Valor Verdadeiro
- VA: Valor Aproximado
Erro Relativo do calor específico do alumínio e do cobre, no qual o valor verdadeiro, do calor sensível segundo a literatura, é de 0,22 cal/gºC e de 0,093 cal/gºC. E o valor aproximado, do resultado experimental, é de 0,29 cal/gºC e de 0,13 cal/gºC.
Alumínio:
Cobre:
Considerando o mínimo de 60% do esperado. O erro relativo do alumínio é de 31,81%, ou seja, aproximamos em 68% do esperado. De um experimento simples, foi bem sucedido.
E o erro relativo do cobre é de 13,97%, ou seja, aproximamos em 86% do esperado, mais do que no experimento anterior, também bem sucedido.
Considerações finais
Experimentalmente conseguimos determinar a capacidade térmica do calorímetro e os calores sensíveis das substâncias, aproximando bastante dos resultados esperados. Com uma a proximidade mínima estabelecida de sessenta por cento.
Ao realizar novamente as medições, e com paciência, diminuímos os erros, dos aparelhos e do operador, possibilitando resultados, como da capacidade energética do calorímetro, facilitar e alcançar resultados com o mínimo de 60% esperado. Tornando a atividade gratificante.
Em toda realização foi bem interessante e divertido ao mesmo tempo, uma perspectiva diferenciada da teoria para a prática em termodinâmica. ||
_____
Texto do Relatório Experimental > D. F. Machado de Oliveira. Curso: Laboratório de Física | Uniandrade, 2019.
SERWAY. Raymond A / JEWETT. John W. - Princípios de Física, Movimentos Ondulatórios e Termodinâmicos. Volume 2. Editora: Cengage Learning. 3ª Edição. São Paulo, 2013.
LAMESA. João Eduardo / TADEU Reginaldo dos Santos. - Física. Volume 1. Editora: Mackenzie. 238ª Edição. São Paulo, 2015.
OLIVEIRA, D. F. Machado de. Experimento de Física: Calor Específico; Blog D Felipe M Oliveira, 2019. Disponível em: <https://blogdfelipemoliveira.webnode.com/l/caloresp ecifico/>. Acesso em: ## mês 20##.